ID intern unic: 377889
Версия на русском

Republica Moldova
din 17.10.2018
de analiză pentru controlul nivelurilor de dioxine, de PCB-uri de tipul
dioxinelor și de PCB-uri care nu sînt de tipul dioxinelor în anumite
produse alimentare
1. Se aprobă metodele de prelevare de probe și metodele de analiză pentru controlul nivelurilor de dioxine, de PCB-uri de tipul dioxinelor și de PCB-uri care nu sînt de tipul dioxinelor în anumite produse alimentare (se anexează).
2. Controlul asupra executării prezentei hotărîri se pune în sarcina Agenției Naționale pentru Siguranța Alimentelor.
3. Prezenta hotărîre intră în vigoare la expirarea a 12 luni de la data publicării.
PRIM-MINISTRU Pavel FILIP
Contrasemnează:
Ministrul afacerilor externe
și integrării europene Tudor Ulianovschi
Ministrul agriculturii,
dezvoltării regionale
și mediului Nicolae Ciubuc
Nr. 1006. Chişinău, 17 octombrie 2018.
prin Hotărîrea Guvernului nr.1006/2018
METODELE DE PRELEVARE DE PROBE ȘI METODELE
DE ANALIZĂ PENTRU CONTROLUL NIVELURILOR DE DIOXINE,
DE PCB-URI DE TIPUL DIOXINELOR ȘI DE PCB-URI CARE NU SÎNT
DE TIPUL DIOXINELOR ÎN ANUMITE PRODUSE ALIMENTARE
Metodele de prelevare de probe și metodele de analiză pentru controlul nivelurilor de dioxine, de PCB-uri de tipul dioxinelorși de PCB-uri care nu sînt de tipul dioxinelor în anumite produse alimentare(în continuare – Metode) transpun prevederile Regulamentului (UE) 2017/644 al Comisiei din 5 aprilie 2017 de stabilire a metodelor de prelevare de probe și a metodelor de analiză pentru controlul nivelurilor de dioxine, de PCB-uri de tipul dioxinelorși de PCB-uri care nu sînt de tipul dioxinelor în anumite produse alimentare, publicat în Jurnalul Oficial al Uniunii Europene seria L nr. 92 din 6 aprilie 2017, p. 9-34,și de abrogare a Regulamentului (UE) nr. 589/2014, publicat în Jurnalul Oficial al Uniunii Europene seria L nr. 54 din 26 februarie 2009, p. 1.1. Metodele de prelevare de probe și metodele de analiză pentru controlul nivelurilor de dioxine, de bifenilpoliclorurat (în continuare – PCB) de tipul dioxinelorși de PCB 28, PCB 52, PCB 101, PCB 138, PCB 153 și PCB 180 (în continuare – PCB-uri care nu sînt de tipul dioxinelor) în anumite produse alimentare stabilesc cerințele de prelevare de probe și cerințele de analiză pentru controlul nivelurilor de dioxine, de PCB-uri de tipul dioxinelorși de PCB-uri care nu sînt de tipul dioxinelor în anumite produse alimentare.
2. În sensul prezentelor Metode se aplică definițiile menționate în Hotărîrea Guvernului nr. 265/2009 pentru aprobarea Regulamentului privind aplicarea metodelor de încercări și interpretarea rezultatelor în domeniul sanitar-veterinar.
Adițional se aplică următoarele definiții:
analit – substanța care trebuie detectată, identificată și/sau cuantificată și derivatele care apar în cursul analizei;
nivel de acțiune – nivelul unei anumite substanțe, care declanșează investigații pentru a identifica sursa respectivei substanțe în cazurile în care sînt detectate niveluri crescute ale substanței;
metode de screening– metodele utilizate pentru selectarea acelor probe cu niveluri de dibenzo-p-dioxinepoliclorurate (în continuare–PCDD)/F-uriși PCB-uri de tipul dioxinelor care depășesc nivelurile maxime sau nivelurile de acțiune. Aceste metode au o capacitate mare de tratare a probelor, eficientă din punctul de vedere al costurilor, sporind astfel șansa de a descoperi noi cazuri în care un grad mare de expunere poate să ducă la riscuri de sănătate pentru consumatori. Metodele de screening se bazează pe metode bioanalitice sau gazcromatografie, cromatografie în fază gazoasă (în continuare – GC)-MS.Rezultatele probelor care depășesc valoarea de prag stabilită pentru verificarea conformității cu nivelul maxim trebuie să fie verificate printr-o nouă analiză completă din proba originală utilizînd o metodă de confirmare;
metode de confirmare– metodele care furnizează informații complete sau complementare care permit identificarea și cuantificarea certă a PCDD/F-urilor și a PCB-urilor de tipul dioxinelor la nivelul maxim sau la nivelul de acțiune. Astfel de metode utilizează gazcromatografia cuplată cu spectrometria de masă de înaltă rezoluție (în continuare – GC-HRMS) sau gazcromatografia cuplată cu spectrometria de masă în tandem (în continuare – GC-MS/MS);
metode bioanalitice– metodele bazate pe principii biologice, cum ar fi bioanalizele celulare, testele bazate pe receptori sau imunoanalizele. Ele nu dau rezultate la nivel de congener, ci oferă doar o indicație a nivelului echivalentului toxic (în continuare – TEQ), exprimată în echivalente bioanalitice (în continuare – BEQ), pentru a ține seama de faptul că este posibil ca nu toți compușii prezenți într-un extract de probă și care determină un răspuns în cadrul analizei să îndeplinească toate cerințele principiului TEQ;
recuperarea aparentă a testului biologic– valoarea nivelului BEQ, calculată pornind de la curba de calibrare a 2,3,7,8-tetraclordibenzo-p-dioxină (în continuare – TCDD) sau PCB 126, corectată cu proba-martor și apoi împărțită la valoarea nivelului TEQ, determinată prin metoda de confirmare. Aceasta vizează corectarea factorilor precum pierderea de compuși PCDD/F și de tipul dioxinelor în timpul etapelor de extracție și curățare, coextragerea compușilor care duc la intensificarea sau atenuarea răspunsului (efecte agonisteși antagoniste), calitatea ajustării curbei sau diferențele dintre valorile factorului de echivalență toxică (în continuare – TEF) și ale potenței relative (în continuare –REP). Recuperarea aparentă a testului biologic se calculează pornind de la probe de referință adecvate cu modele pentru congeneri reprezentativi în jurul nivelului maxim sau al nivelului de acțiune;
analiză duplicat– analiza separată a analiților, folosind o a doua parte alicotă din aceeași probă omogenizată;
limită specifică acceptată de cuantificare a unui congener individual într-o probă– concentrația minimă a unui analit care poate fi măsurată și îndeplinește criteriile de identificare;
limita de cuantificare a unui congener individual poate fi definită ca:
a) concentrația de analit în extractul unei probe care produce un răspuns instrumental la doi ioni diferiți, ce urmează să fie controlați cu un raport semnal/zgomot (în continuare – S/Z) de 3:1 pentru semnalul mai puțin intens;
sau, în cazul în care calcularea raportului S/Z nu furnizează rezultate fiabile din motive tehnice,
b) punctul corespunzător celei mai scăzute concentrații de pe o curbă de calibrare, care prezintă o deviere acceptabilă (≤ 30%) și consecventă (măsurată cel puțin la începutul și la sfîrșitul unei serii de probe) de la media factorului de răspuns relativ pentru toate punctele de pe curba de etalonare, în fiecare serie de probe;
estimare superioară– conceptul care presupune utilizarea limitei de cuantificare pentru contribuția fiecărui congener necuantificat;
estimare inferioară– conceptul care presupune utilizarea valorii zero pentru contribuția fiecărui congener necuantificat;
estimare mediană– conceptul care presupune ca, la calculul contribuției fiecărui congener necuantificat, să se utilizeze jumătate din limita de cuantificare;
lot– cantitatea identificabilă de produse alimentare, livrată odată, pentru care funcționarul stabilește că au caracteristici comune, cum ar fi originea, varietatea, tipul de ambalaj, ambalatorul, expeditorul sau marcajele. În cazul peștilor și al produselor pescărești, mărimea peștilor trebuie să fie, de asemenea, comparabilă. În cazul în care mărimea și/sau greutatea peștilor nu sînt comparabile în cadrul unui transport, acesta poate să fie totuși luat în considerare ca fiind un lot, însă trebuie să i se aplice o procedură specifică de prelevare de probe;
sublot– partea dintr-un lot mare definită în scopul de a aplica metoda de prelevare a probelor respectivei părți. Fiecare sublot trebuie să fie separat fizic și identificabil;
probă elementară– cantitatea de material prelevată dintr-un singur loc din lot sau sublot;
probă agregată– proba rezultată prin combinarea tuturor probelor elementare prelevate dintr-un lot sau sublot;
probă de laborator– partea/cantitatea reprezentativă din proba agregată destinată laboratorului.
Capitolul II
METODELE DE PRELEVARE A PROBELOR PENTRU CONTROLUL
OFICIAL AL NIVELURILOR DE DIOXINE (PCDD/DIBENZOFURANI
POLICLORURAȚI), DE PCB-URI DE TIPUL DIOXINELOR ȘI DE
PCB-URI CARE NU SÎNT DE TIPUL DIOXINELOR DIN ANUMITE
PRODUSE ALIMENTARE
Cerințele de prelevare a probelor
3. Probele destinate controlului oficial al nivelurilor de dioxine (PCDD/F), de PCB-uri de tipul dioxinelorși de PCB-uri care nu sînt de tipul dioxinelor din produsele alimentare se realizează în conformitate cu metodele descrise în prezentul capitol. Probele agregate astfel obținute se consideră reprezentative pentru loturile sau subloturile din care sînt prelevate.
5. Pentru a asigura respectarea dispozițiilor de la articolul 3 alineatele (2)- (6) din Legea nr. 296/2017 privind cerințele generale de igienă a produselor alimentare, operatorii din domeniul alimentar, la prelevarea de probe pentru controlul nivelurilor de dioxine (PCDD/F), de PCB-uri de tipul dioxinelorși de PCB-uri care nu sînt de tipul dioxinelor, aplică metodele descrise în secțiunea a 2-a sau se aplică o procedură de prelevare de probe echivalentă, despre care s-a demonstrat că are același nivel de reprezentativitate ca și procedura de prelevare descrisă în secțiunea a 2-a.
Secțiunea a 2-a
Planul de prelevare a probelor
14. Metoda de prelevare a probelor aplicată trebuie să asigure reprezentativitatea probei agregate pentru (sub)lotul controlat. Loturile mari se împart în subloturi, cu condiția ca sublotul să poată fi separat fizic. Pentru produsele comercializate în transporturi vrac mari (de exemplu uleiurile vegetale), se aplică valorile din tabelul 1. Pentru alte produse se aplică valorile din tabelul 2. Avînd în vedere faptul că greutatea unui lot nu este întotdeauna un multiplu exact al greutății subloturilor, greutatea sublotului poate depăși greutatea menționată cu maximum 20%.
Tabelul 1
|
Greutatea lotului (în tone)
|
Greutatea sau numărul de subloturi
|
|
≥ 1 500
|
500 de tone |
|
> 300 și < 1 500
|
3 subloturi |
|
≥ 50 și ≤ 300 |
100 de tone |
|
< 50
|
—
|
|
Greutatea lotului (în tone)
|
Greutatea sau numărul de subloturi
|
|
≥ 15
|
15-30 de tone |
|
< 15
|
—
|
15. Numărul minim de probe elementare care sînt prelevate din lot sau din sublot este cel indicat în tabelele 3 și 4.
Tabelul 3
Numărul minim de probe elementare de prelevat din lot sau sublot
|
Greutatea sau volumul lotului/sublotului (în kg sau litri) |
Numărul minim de probe elementare de prelevat |
|
< 50
|
3
|
|
între 50 și 500
|
5
|
|
> 500 |
10
|
19.Dacă lotul sau sublotul constă în pachete sau unități individuale, numărul de pachete sau de unități de prelevat pentru a forma o probăagregată este menționat în tabelul 4.
Tabelul 4
Numărul de pachete sau de unități (probe elementare) de prelevat
pentru a constitui proba agregată în cazul în care lotul sau sublotul
este format din pachete sau unități individuale
|
Numărul de pachete sau de unități din lot/sublot
|
Numărul de pachete sau de unități de prelevat |
|
între 1 și 25 |
cel puțin 1 pachet sau 1 unitate
|
|
între 26 și 100 |
aproximativ 5%, cel puțin 2 pachete sau unități
|
|
> 100 |
aproximativ 5%, maximum 10 pachete sau unități
|
20. Se consideră că peștii au mărimi și greutăți comparabile atunci cînd diferența de mărime și greutate nu depășește aproximativ 50%. Numărul de probe elementare de prelevat din lot este menționat în tabelul 3. Proba agregată care reunește toate probele elementare trebuie să fie de cel puțin 1 kg. La prelevarea de probe din loturi care conțin pești întregi cu mărimi și greutăți comparabile se aplică următoarele cerințe:
1) atunci cînd lotul din care se prelevă probe conține pești mici (pești individuali care cîntăresc mai puțin de 1 kg), aceștia se prelevă întregi ca probe elementare pentru a constitui proba agregată. Atunci cînd proba agregată care rezultă cîntărește mai mult de 3 kg, probele elementare pot fi constituite din partea de mijloc, cîntărind fiecare cel puțin 100 g, a peștilor care formează proba. Pentru omogenizarea probei, se utilizează întreaga parte căreia îi este aplicabil nivelul maxim. Partea din mijloc a peștelui este cea unde se află centrul de greutate. Acesta este localizat, în cele mai multe cazuri, la nivelul aripioarei dorsale (în cazul în care peștele are aripioară dorsală) sau la mijlocul distanței dintre branhii și anus;
2)atunci cînd lotul din care se prelevă probe conține pești mai mari (fiecare cîntărind mai mult de 1 kg), proba elementară este reprezentată de partea din mijloc a peștelui. Fiecare probă elementară cîntărește cel puțin 100 g. În cazul peștilor de mărime intermediară (1-6 kg), proba elementară constă dintr-o bucată prelevată în secțiune transversală între coloana vertebrală și abdomen, din partea din mijloc a peștelui. În cazul peștilor foarte mari (de exemplu mai mari de 6 kg), proba elementară este prelevată din masa muscularădorsolateralăde pe partea dreaptă (vedere frontală), din partea de mijloc a peștelui. Atunci cînd prelevarea unei bucăți din partea de mijloc a peștelui ar însemna un prejudiciu economic semnificativ, se poate considera suficientă prelevarea a trei probe elementare,cîntărind fiecare cel puțin 350 g, indiferent de mărimea lotului sau, ca alternativă, se poate preleva cîte o parte egală din masa musculară din apropierea cozii și din cea din apropierea capului unui pește pentru a se forma proba elementară reprezentativă pentru nivelul de dioxine din peștele întreg.
21.La prelevarea de probe din loturile de pește care conțin pești întregi de mărimi și/sau greutăți diferite, se aplică următoarele cerințe:1) în ceea ce privește constituirea probei, se aplică dispozițiile de la punctul 20;
2) atunci cînd predomină o clasă/categorie de mărime sau de greutate (80% sau mai mult din lot), proba se prelevă de la peștii de mărimea sau greutatea predominantă. Această probă se consideră reprezentativă pentru întregul lot;
3) atunci cînd nu predomină o anumită clasă/categorie de mărime sau de greutate, trebuie să se asigure faptul că peștii selectați în vederea prelevării de probe sînt reprezentativi pentru lot.
22.Prelevarea probelor din produsele alimentare în etapa de vînzare cu amănuntul se face în conformitate cu dispozițiile privind prelevarea probelor stabilite la punctul 7.Atunci cînd nu este posibil, se poate utiliza o metodă alternativă de prelevare a probelor, cu condiția să se asigure o reprezentativitate suficientă a lotului sau sublotului din care se prelevă probele.
Secțiunea a 3-a
Conformitatea lotului cu specificațiile
23. Pentru PCB-urile care nu sînt de tipul dioxinelor, lotul este considerat conform dacă rezultatul analitic pentru suma PCB-urilor nu depășește nivelul maxim specificat în HotărîreaGuvernului nr. 520/2010cu privire la aprobarea Regulamentului sanitar privind contaminanții din produsele alimentare. Lotul este considerat neconform în cazul în care media a două limite superioare ale rezultatelor analitice obținute printr-o analiză duplicat depășește nivelul maxim, ținînd seama de incertitudinea de măsurare extinsă (în continuare – U). U se calculează utilizîndu-se un coeficient de acoperire cu valoarea 2, care conferă un nivel de încredere de 95%. Un lot este considerat neconform dacă media valorilor măsurate minus incertitudinea extinsă a mediei depășește nivelul maxim stabilit. Normele menționate în acest punct se aplică pentru rezultatul analitic obținut pe proba pentru controlul oficial.
1) efectuate printr-o metodă de screening cu o rată de rezultate fals conforme sub 5% arată că nivelul nu depășește nivelul maxim respectiv de PCDD/F-uri și suma dintre PCDD/F-uri și PCB-uri de tipul dioxinelor, astfel cum sînt prevăzute în HotărîreaGuvernului nr. 520/2010 cu privire la aprobarea Regulamentului sanitar privind contaminanții din produsele alimentare;
2) efectuate printr-o metodă de confirmare nu depășește nivelul maxim respectiv de PCDD/F-uri și suma dintre PCDD/F-uri și PCB-uri de tipul dioxinelor, astfel cum sînt prevăzute în HotărîreaGuvernului 520/2010 cu privire la aprobarea Regulamentului sanitar privind contaminanții din produsele alimentare.
Pentru testele de screening, se stabilește o valoare de prag aplicabilă în decizia asupra conformității cu nivelurile maxime respective stabilite fie pentru PCDD/F-uri, fie pentru suma dintre PCDD/F-uri și PCB-uri de tipul dioxinelor.
Lotul este considerat neconform cu nivelul maxim specificat în HotărîreaGuvernului nr. 520/2010 cu privire la aprobarea Regulamentului sanitar privind contaminanţii din produsele alimentare în cazul în care media a două limite superioare ale rezultatelor analitice (analiză duplicat) obținute utilizînd o metodă de confirmare depășește nivelul maxim, ținînd seama de incertitudinea de măsurare extinsă.
Incertitudinea de măsurare extinsă se calculează utilizîndu-se un coeficient de acoperire cu valoarea 2, care conferă un nivel de încredere de 95%. Un lot este considerat neconform dacă media valorilor măsurate minus incertitudinea extinsă a mediei depășește nivelul maxim stabilit.
Suma incertitudinilor extinse estimate ale rezultatelor analitice separate pentru PCDD/F-uri și PCB-uri de tipul dioxinelor trebuie utilizată pentru incertitudinea extinsă estimată a sumei dintre PCDD/F-uri și PCB-uri de tipul dioxinelor.
Normele menționate în prezentul punctse aplică pentru rezultatul analitic obținut pe proba pentru controlul oficial.
PREGĂTIREA PROBELOR ȘI CERINȚELE PRIVIND METODELE DE
ANALIZĂ UTILIZATE ÎN CADRUL CONTROLULUI NIVELURILOR
DE DIOXINE (PCDD/F-URI) ȘI DE PCB-URI DE TIPUL DIOXINELOR
DIN ANUMITE PRODUSE ALIMENTARE
26.Cerințele stabilite în prezentul capitol se aplică atunci cînd produsele alimentare sînt analizate în cadrul controlului oficial al conținuturilor de dibenzo-p-dioxinepoliclorurateși de dibenzofuranipoliclorurați 2,3,7,8-substituiți (PCDD/F-uri) și PCB-uri de tipul dioxinelor, precum și în pregătirea probelor și în efectuarea încercărilor de laborator pentru a asigura respectarea dispozițiilor Legii nr. 296/2017 privind cerințele generale de igienă a produselor alimentare.
27. Monitorizarea prezenței PCDD/F-urilor și a PCB-urilor de tipul dioxinelor în produsele alimentare poate fi efectuată cu două tipuri diferite de metode de analiză:
1) metodele de screening
a)obiectivul metodelor de screening este selectarea acelor probe în care nivelurile de PCDD/F-uri și de PCB-uri de tipul dioxinelor depășesc nivelurile maxime sau nivelurile de acțiune. Aceste metode de screening au o capacitate mare de tratare a probelor, eficientă din punctul de vedere al costurilor, sporind astfel șansa de a descoperi noi circumstanțe în care un grad mare de expunere poate să ducă la riscuri de sănătate pentru consumatori. Aplicarea lor urmărește evitarea rezultatelor fals conforme. Ele pot să cuprindă metode bioanaliticeși metode GC-MS;
b) metodele de screening compară rezultatul analitic cu o valoare de prag, determinînd o decizie de tip da/nu cu privire la eventuala depășire a nivelului maxim sau a nivelului de acțiune. Concentrația de PCDD/F-uri și suma dintre PCDD/F-uri și PCB-uri de tipul dioxinelor din probele suspecte de neconformitate cu nivelul maxim trebuie determinate sau confirmate printr-o metodă de confirmare;
c) în plus, metodele de screening pot să dea o indicație despre nivelurile de PCDD/F-uri și de PCB-uri de tipul dioxinelor prezente în probă. În cazul aplicării unor metode de screening bioanalitice, rezultatul este exprimat ca BEQ, în timp ce în cazul aplicării metodelor fizico-chimice GC-MS, acesta este exprimat ca TEQ. Rezultatele metodelor de screening exprimate numeric sînt utile pentru a dovedi conformitatea sau suspiciunea de neconformitate sau depășirea nivelurilor de acțiune și oferă o indicație a intervalului în care se situează concentrațiile în vederea monitorizării prin metode de confirmare. Acestea nu sînt adecvate pentru scopuri precum evaluarea nivelurilor de fond, aprecierea gradului de expunere, urmărirea tendințelor pe care le urmează concentrațiile în timp sau reevaluarea nivelurilor maxime și a celor de acțiune;
2) metodele de confirmare
Metodele de confirmare permit identificarea și cuantificarea fără echivoc a PCDD/F-urilor și PCB-urilor de tipul dioxinelor prezente într-o probă și oferă informații depline pentru fiecare congener. Prin urmare, aceste metode permit controlarea nivelurilor maxime și a nivelurilor de acțiune, inclusiv confirmarea rezultatelor obținute prin metodele de screening. În plus, rezultatele pot fi folosite și pentru alte scopuri, precum determinarea nivelurilor de fond mici în cadrul monitorizării produselor alimentare, monitorizarea tendințelor în timp, evaluarea expunerii populației și crearea unei baze de date pentru eventuala reevaluare a nivelurilor de acțiune și a nivelurilor maxime. Ele sînt, de asemenea, importante pentru stabilirea recurenței apariției anumitor congeneri în scopul de a identifica sursa unei posibile contaminări. Astfel de metode utilizează GC-HRMS. Pentru confirmarea conformității sau a neconformității cu nivelurile maxime poate fi folosită și GC-MS/MS.
Factorii de echivalență toxică OMS-TEF pentru evaluarea
|
Congener
|
Valoare TEF
|
Congener
|
Valoare TEF
|
|
Dibenzo-p-dioxine („PCDD-uri”)
|
PCB-uri „de tipul dioxinelor”
PCB-urinon-orto + PCB-urimono-orto
|
||
|
2,3,7,8-TCDD
|
1
|
|
|
|
1,2,3,7,8-PeCDD
|
1
|
PCB-urinon-orto
|
|
|
1,2,3,4,7,8-heca (în continuare – Hx)CDD
|
0,1
|
PCB 77
|
0,0001
|
|
1,2,3,6,7,8-HxCDD
|
0,1
|
PCB 81
|
0,0003
|
|
1,2,3,7,8,9-HxCDD
|
0,1
|
PCB 126
|
0,1
|
|
1,2,3,4,6,7,8-HpCDD
|
0,01
|
PCB 169
|
0,03
|
|
OCDD
|
0,0003
|
|
|
|
Dibenzofurani („PCDF-uri”)
|
PCB-urimono-orto
|
||
|
2,3,7,8-TCDF
|
0,1
|
PCB 105
|
0,00003
|
|
1,2,3,7,8-PeCDF
|
0,03
|
PCB 114
|
0,00003
|
|
2,3,4,7,8-PeCDF
|
0,3
|
PCB 118
|
0,00003
|
|
1,2,3,4,7,8-HxCDF
|
0,1
|
PCB 123
|
0,00003
|
|
1,2,3,6,7,8-HxCDF
|
0,1
|
PCB 156
|
0,00003
|
|
1,2,3,7,8,9-HxCDF
|
0,1
|
PCB 157
|
0,00003
|
|
2,3,4,6,7,8-HxCDF
|
0,1
|
PCB 167
|
0,00003
|
|
1,2,3,4,6,7,8-hepta(în continuare – Hp)CDF
|
0,01
|
PCB 189
|
0,00003
|
|
1,2,3,4,7,8,9-HpCDF
|
0,01
|
|
|
|
OCDF
|
0,0003
|
|
|
|
|
|||
29.Metodele de screening și de confirmare pot fi aplicate pentru controlul unei anumite matrice numai dacă metodele sînt suficient de sensibile pentru a detecta în mod fiabil niveluri în zona nivelului maxim de acțiune.
Cerințele de asigurare a calității și cerințele pentru laborator
30. Trebuie luate măsuri pentru a se evita contaminarea încrucișată în fiecare etapă a procedurii de prelevare de probe și de analizare.
Cerințele de bază privind procedurile analitice referitoare la dioxine
(PCDD/F-uri) și PCB-uri de tipul dioxinelor
1) în timpul procedurii de validare și/sau în timpul analizei de rutină, laboratoarele demonstrează performanța unei metode în intervalul nivelului maxim, de exemplu 0,5x, 1x și 2x nivelul maxim, cu un coeficient de variație acceptabil pentru analize repetate;
2) ca măsuri interne de control al calității se efectuează periodic controale-martor, experimente cu îmbogățire sau analize ale unor probe de control (preferabil, dacă este posibil, cu material de referință certificat). Se înregistrează și se verifică grafice de control al calității (în continuare – QC) pentru controalele-martor, experimentele cu îmbogățire sau analizele unor probe de control, pentru a se garanta că performanța analitică este conformă cerințelor.
Criteriile analitice pentru valoarea TEQ, respectiv BEQ
|
Indicatori
|
Screening cu metode bioanalitice sau fizico-chimice |
Metode de confirmare
|
|
Rată a rezultatelor fals conformehttps://eur-lex.europa.eu/legal-content/ro/TXT/?uri=CELEX:32017R0644 - ntr*1-L_2017092RO.01001901-E0002 (limita maximă) |
< 5 %
|
|
|
Fidelitate
|
|
– 20% și +20%
|
|
Repetabilitate (RSDr)
|
< 20%
|
|
|
Precizie intermediară (RSDR)
|
< 25%
|
< 15%
|
1) atît GC-MS, cîtși metodele bioanalitice pot fi folosite pentru screening. Pentru metodele GC-MS trebuie utilizate cerințele prevăzute la secțiunea a 4-a. Pentru metodele bioanalitice bazate pe celule sînt prevăzute cerințe specifice la secțiunea a 5-a;
2) laboratoarele care aplică metode de screening pentru controlul de rutină al probelor stabilesc o cooperare strînsă cu laboratoarele care aplică metoda de confirmare;
3) performanța metodei de screening trebuie verificată în timpul analizei de rutină, printr-un control al calității analizelor și printr-o validare continuă a metodei. Trebuie să existe un program continuu pentru controlul rezultatelor conforme;
4) 20% din extractele de probe se măsoară în screeningul de rutină cu și fără TCDD care se adaugă în funcție de nivelul maxim sau de acțiune, pentru a verifica dacă răspunsul este, eventual, suprimat de către substanțele interferente prezente în extractul de probă. Concentrația măsurată a probei îmbogățite se compară cu suma dintre concentrația extractului neîmbogățit și concentrația cu îmbogățire. Dacă această concentrație măsurată este mai mică cu mai mult de 25% față de concentrația (suma) calculată, aceasta indică posibilitatea eliminării semnalului, iar proba respectivă trebuie supusă analizei de confirmare. Rezultatele sînt monitorizate prin grafice de control al calității;
5) 2-10% din probele conforme, în funcție de matricea probei și de experiența laboratorului, se supun analizei de confirmare;
6) se determină rata rezultatelor fals conforme care rezultă din screeningul probelor sub și peste nivelul maxim sau de acțiune. Ratele reale de rezultate fals conforme trebuie să fie sub 5%. Atunci cînd, în urma controlului de calitate al probelor conforme, sînt disponibile cel puțin 20 de rezultate confirmate per matrice/grup de matrice, concluziile privind rata de rezultate fals conforme trebuie să fie desprinse din această bază de date. Rezultatele probelor analizate prin intermediul testărilor interlaboratoare sau în timpul incidentelor de contaminare, care acoperă un interval de concentrații de pînă la, de exemplu 2x nivelul maxim (NM), pot fi, de asemenea, incluse în cele minimum 20 de rezultate pentru evaluarea ratei de rezultate fals conforme. Probele acoperă cele mai frecvente modele de congeneri, reprezentînd diverse surse. Deși testele de screening urmăresc în mod preferențial să detecteze probele care depășesc nivelul de acțiune, criteriul de determinare a ratelor de rezultate fals conforme este nivelul maxim, ținînd seama de incertitudinea de măsurare extinsă a metodei de confirmare;
7) probele potențial neconforme care rezultă în urma screeningului trebuie să fie întotdeauna verificate printr-o nouă analiză completă a probei originale, efectuată printr-o metodă de confirmare. Aceste probe pot fi, de asemenea, folosite pentru a evalua rata rezultatelor fals neconforme. Pentru metodele de screening, rata rezultatelor fals neconforme este procentul rezultatelor confirmate ca fiind conforme în urma analizei de confirmare, în timp ce, în screeningul anterior, s-a declarat că proba este suspectată de a fi neconformă. În schimb, evaluarea caracterului avantajos al metodei de screening se bazează pe compararea probelor fals neconforme cu numărul total de probe verificate. Această rată trebuie să fie suficient de mică pentru a face ca utilizarea unui instrument de screening să fie avantajoasă;
8) în condiții de validare, metodele bioanalitice oferă o indicație valabilă a nivelului TEQ, calculat și exprimat ca BEQ;
9) pentru metodele bioanalitice aplicate în condiții de repetabilitate, valoarea RSDrintralaborator ar fi, de regulă, mai mică decît RSDR (reproductibilitate).
Cerințe specifice privind metodele GC-MS care trebuie respectate
în scop de screening sau de confirmare
1) pentru a se valida procedura analitică, la începutul efectuării analizei, de exemplu înaintea fazei de extracție, trebuie să se adauge etaloane interne de PCDD/F-uri substituite cu clor la pozițiile 2,3,7,8 și marcate cu 13C, precum și etaloane interne de PCB-uri de tipul dioxinelor marcate cu 13C. Trebuie adăugat cel puțin un congener pentru fiecare din grupele omoloage tetra-pînă la octoclorurate de PCDD/F-uri și cel puțin un congener pentru fiecare dintre grupele omoloage de PCB-uri de tipul dioxinelor (alternativ, cel puțin un congener pentru fiecare funcție de înregistrare a ionului selecționat prin spectrometrie de masă, utilizat pentru monitorizarea PCDD/F-urilor și a PCB-urilor de tipul dioxinelor). În cazul metodelor de confirmare, trebuie să fie utilizate toate cele 17 etaloane interne de PCDD/F-uri substituite la pozițiile 2,3,7,8 și marcate cu 13C, precum și toate cele 12 etaloane interne de PCB-uri de tipul dioxinelor marcate cu 13C;
2) se determină factorii de răspuns relativ pentru acei congeneri pentru care nu se adaugă niciun analog marcat cu 13C, utilizîndu-se soluții de calibrare corespunzătoare;
3) pentru produsele alimentare de origine vegetală și cele de origine animală care conțin mai puțin de 10% grăsime este obligatorie adăugarea etaloanelor interne înainte de extracție. Pentru produsele alimentare de origine animală care conțin mai mult de 10% grăsime, etaloanele interne se pot adăuga fie înainte, fie după extracția grăsimii. Se procedează la o validare corespunzătoare a eficacității extracției, în funcție de etapa în care se introduc etaloanele interne și de modul în care sînt prezentate rezultatele (pe bază de produs sau de grăsimi);
4) înaintea analizei GC-MS trebuie să se adauge unul sau două etaloane de recuperare (surogat);
5) pentru metodele de confirmare, recuperările de etaloane interne individuale trebuie să se situeze în intervalul 60-120%. Sînt acceptabile recuperări inferioare sau superioare pentru congeneri individuali, în special pentru unele dibenzo-p-dioxineși unii dibenzofuranihepta-și octoclorurați, atît timp cît contribuția acestora la valoarea TEQ nu depășește 10% din valoarea TEQ totală (bazată pe suma dintre PCDD/F-uri și PCB-uri de tipul dioxinelor). Pentru metodele de screening GC-MS, recuperarea trebuie să se situeze în intervalul 30-140%.
1)separarea PCDD/F-urilor de compușii clorurați interferenți, cum sîntPCB-urile care nu sînt de tipul dioxinelorși bifenileterii clorurați, se realizează prin tehnici cromatografice adecvate (de preferință pe coloană de florisil, alumină și/sau cărbune);
2) separarea izomerilor prin gazcromatografie trebuie să fie suficientă (<25% de la pic la pic între 1,2,3,4,7,8-HxCDF și 1,2,3,6,7,8-HxCDF).
a) în HRMS, rezoluția caracteristică trebuie să fie mai mare sau egală cu 10 000 pentru toată plaja maselor, cu o concavitate de 10%;
b) îndeplinirea altor cerințe în materie de identificare și confirmare, astfel cum sînt descrise în standardele internațional recunoscute;
2) pentru GC-MS/MS:
a) monitorizarea a cel puțin 2 ioni precursori specifici, fiecare cu un anumit ion de tranziție corespunzător produs pentru toți analiții marcați și nemarcați în domeniul de aplicare al analizei;
b) toleranța maximă admisă a intensității relative de ± 15% pentru anumiți ioni de tranziție selecționați produși în comparație cu valorile calculate sau măsurate (media din standardele de calibrare), aplicînd condiții MS/MS identice, în special energia coliziunii și presiunea gazului de coliziune, pentru fiecare tranziție a unui analit;
c) rezoluția pentru fiecare cuadrupol trebuie să fie setată ca egală sau mai mare decît rezoluția unității de masă (rezoluția unității de masă: o rezoluție suficientă pentru a separa două picuri la distanță de o unitate de masă), pentru a se minimiza interferențele posibile cu analiții de interes;
d) îndeplinirea altor cerințe descrise în standardele internațional recunoscute.
Cerințele specifice pentru metodele bioanalitice
O metodă de screening clasifică o probă ca fiind conformă sau suspectată a fi neconformă. În acest scop, nivelul BEQ calculat este comparat cu valoarea de prag. Probele sub valoarea de prag sînt declarate conforme, iar probele egale sau peste valoarea de prag sînt declarate ca fiind suspectate a fi neconforme, necesitînd analizarea printr-o metodă de confirmare. În practică, un nivel BEQ corespunzînd la două treimi din nivelul maxim poate servi drept valoare de prag cu condiția să se asigure o rată de rezultate fals conforme sub 5% și o rată acceptabilă pentru rezultatele fals neconforme. Cu niveluri maxime diferite pentru PCDD/F-uri și pentru suma dintre PCDD/F-uri și PCB-uri de tipul dioxinelor, verificarea conformității probelor fără fracționare necesită valori de prag corespunzătoare ale testelor biologice pentru PCDD/F-uri. Pentru verificarea probelor care depășesc nivelurile de acțiune, ar conveni ca valoare de prag un procentaj corespunzător al nivelului de acțiune respectiv.
În cazul în care nivelul indicativ este exprimat în BEQ, rezultatele pentru probă trebuie să fie furnizate în intervalul de lucru și să depășească limita de raportare.
1) atunci cînd se calculează concentrațiile pornind de la o curbă de calibrare a TCDD, valorile la extremitatea superioară a curbei vor prezenta o variație importantă (coeficient de variație (în continuare – CV) ridicat). Intervalul de lucru este aria în care acest CV este mai mic de 15%. Extremitatea inferioară a intervalului de lucru (limita de raportare) trebuie să fie fixată semnificativ (cel puțin cu un factor de trei) peste probele-martor din cadrul procedurii. Extremitatea superioară a intervalului de lucru este, de obicei, reprezentată de valoarea EC70 (70% din concentrația maximă efectivă), dar mai scăzută dacă CV este mai mare de 15% în acest interval. Intervalul de lucru este stabilit în timpul validării. Valorile de prag trebuie să se situeze în intervalul de lucru;
2) soluțiile etalon și extractele de probe trebuie să fie testate în triplicat sau cel puțin în duplicat. Atunci cînd se utilizează duplicate, o soluție etalon sau un extract de control testat(ă) în patru pînă la șase godeuri repartizate pe placă produce un răspuns sau o concentrație (posibilă doar în intervalul de lucru) pe baza unui CV < 15%.
1) calibrarea cu curba standard
a) nivelurile din probe pot fi estimate prin compararea răspunsului la test cu o curbă de calibrare a TCDD (sau a PCB 126 sau a unui amestec etalon de PCDD/F-uri/PCB-uri de tipul dioxinelor) pentru a se calcula nivelul BEQ din extract și, prin urmare, din probă;
b) curbele de calibrare conțin între 8 și 12 concentrații (cel puțin în duplicat), cu un număr suficient de concentrații în partea inferioară a curbei (intervalul de lucru). Se acordă o atenție specială calității ajustării curbei în intervalul de lucru. Valoarea R2 ca atare are valoare redusă sau nicio valoare în estimarea calității ajustării în regresia nelineară. Se ajunge la o ajustare mai bună prin reducerea la minimum a diferenței dintre nivelurile calculate și cele observate în intervalul de lucru al curbei (de exemplu prin reducerea la minimum a sumei pătratelor reziduurilor);
c) nivelul estimat în extractul de probă este corectat ulterior cu nivelul BEQ calculat pentru o probă-martor de matrice sau de solvent (pentru a ține seama de impuritățile din solvenți și din substanțele chimice utilizate) și cu recuperarea aparentă (calculată pornind de la nivelul BEQ al unor probe de referință adecvate, cu modele reprezentative de congeneri în jurul nivelului maxim sau al nivelului de acțiune). Pentru a efectua o corecție cu recuperarea, recuperarea aparentă trebuie să fie situată întotdeauna în intervalul necesar. Probele de referință utilizate pentru corecția cu recuperarea trebuie să respecte cerințele de la punctul 63;
2) calibrarea cu probe de referință
Alternativ, poate fi utilizată o curbă de calibrare realizată pe baza a cel puțin 4 probe de referință: o matrice-martor, plus trei probe de referință de 0,5x, 1x și 2x nivelul maxim sau nivelul de acțiune, eliminînd necesitatea de a aplica o corecție cu proba-martor și cu recuperarea, dacă proprietățile matricei probelor de referință corespund celor ale probelor necunoscute. În acest caz, răspunsul la test corespunzînd la două treimi din nivelul maxim poate fi calculat direct din aceste probe și utilizat ca valoare de prag. Pentru verificarea probelor care depășesc nivelurile de acțiune, un procentaj corespunzător al acestor niveluri de acțiune ar corespunde ca valoare de prag.
1) probele de referință reprezintă matricea probei, modelele de congeneri și intervalele de concentrație pentru PCDD/F-uri și PCB-uri de tipul dioxinelor în jurul nivelului maxim sau al nivelului de acțiune;
2) în fiecare serie de teste se include un martor pentru procedură sau, de preferință, un martor pentru matrice, precum și o probă de referință la nivelul maxim sau la nivelul de acțiune. Aceste probe trebuie extrase și testate în același timp și în condiții identice. Proba de referință trebuie să prezinte un răspuns clar mai puternic în comparație cu proba-martor, asigurînd astfel caracterul adecvat al testului. Probele respective pot fi utilizate pentru corecțiile cu proba-martor și cu recuperarea;
3) probele de referință alese pentru a efectua o corecție cu recuperarea sînt reprezentative pentru probele testate, în sensul că modelele de congeneri nu conduc la o subestimare a nivelurilor;
4)se pot include probe de referință suplimentare, de exemplu de 0,5x și 2x nivelul maxim sau nivelul de acțiune, pentru a se demonstra eficacitatea testului în intervalul de interes pentru controlul nivelului maxim sau al nivelului de acțiune. Combinate, aceste probe pot fi utilizate pentru calcularea nivelurilor BEQ în probele de testare.
Valorile de prag se stabilesc pentru deciziile privind conformitatea probelor cu nivelurile maxime sau pentru controlul nivelurilor de acțiune, în cazul în care prezintă interes, nivelurile maxime sau de acțiune respective fiind stabilite fie numai pentru PCDD/F-uri și PCB-uri de tipul dioxinelor, fie pentru suma dintre PCDD/F-uri și PCB-uri de tipul dioxinelor. Ele sînt reprezentate de limita inferioară a curbei de distribuție a rezultatelor bioanalitice (corectate pentru martor și recuperare) corespunzînd limitei de decizie aferente metodei de confirmare pe baza unui nivel de încredere de 95%, implicînd o rată de rezultate fals conforme < 5%, și pe baza unei valori a RSDR< 25%. Limita de decizie aferentă metodei de confirmare este nivelul maxim, ținînd seama de incertitudinea de măsurare extinsă.
Valoarea de prag (în BEQ) poate fi calculată prin metodeleprevăzute în figură:
1) utilizarea sectorului inferior al intervalului de predicție de 95% la limita de decizie aferentă metodei de confirmare
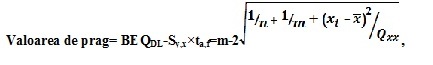
BEQDL – BEQ care corespunde limitei de decizie aferente metodei de confirmare, fiind nivelul maxim care ține seama de incertitudinea de măsurare extinsă;
Sy,x –deviația standard reziduală;
t α,f = m-2 –factor student (α = 5%, f = grade de libertate, o singură parte);
m – numărul total de puncte de calibrare (indice j);
n – numărul de repetări la fiecare nivel;
xi– concentrația probei (în TEQ) în punctul de calibrare I determinată printr-o metodă de confirmare;

SDR – deviația standard a rezultatelor testului biologic la BEQDL, măsurată în condiții de reproductibilitate intralaborator;
3)calculul ca valoare medie a rezultatelor bioanalitice (în BEQ, corectate pentru martor și recuperare) din mai multe analize ale probelor (n ≥ 6) contaminate la două treimi din nivelul maxim sau din nivelul de acțiune. Acesta se bazează pe observația că acest nivel va fi în jurul valorii de prag determinate conform punctului 69subpunctele 1) și 2). Calculul valorilor de prag, bazat pe un nivel de încredere de 95%, implicînd o rată a rezultatelor fals conforme < 5% și o valoare a RSDR< 25%:
a) pornind de la sectorul inferior al intervalului de predicție de 95% la limita de decizie aferentă metodei de confirmare;
b) pornind de la analize multiple ale probelor (n ≥ 6) contaminate la limita de decizie aferentă metodei de confirmare, ca limită inferioară a distribuției datelor (reprezentată în figură printr-o curbă sub formă de clopot) la valoarea medie BEQ corespunzătoare;
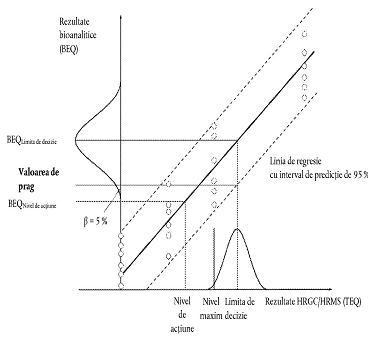
Figură. Calculareavalorii pe prag(în BEQ)
4) valorile de prag bazate pe BEQ, calculate pornind de la RSDR obținut în cursul validării, utilizînd un număr limitat de probe cu modele de matrice/congeneri diferite, pot fi mai mari decît nivelurile maxime sau de acțiune bazate pe TEQ datorită unei precizii mai mari decît cea realizabilă în analizele de rutină atunci cînd trebuie controlat un spectru necunoscut de posibile modele de congeneri. În astfel de cazuri, valorile de prag se calculează pornind de la RSDR = 25% sau se preferă două treimi din nivelul maxim sau din nivelul de acțiune.
1) avînd în vedere faptul că nu se pot utiliza etaloane interne în metodele bioanalitice, se efectuează teste cu privire la repetabilitate pentru obținerea de informații privind deviația standard în cadrul unei serii de teste și între serii de teste. Repetabilitatea trebuie să fie sub 20%, iar reproductibilitatea intralaborator sub 25%. Aceasta se bazează pe nivelurile calculate în BEQ după corecția cu proba-martor și cu recuperarea;
2) ca parte din procesul de validare, testul trebuie să permită diferențierea între o probă-martor și un nivel la valoarea de prag, permițînd identificarea probelor peste valoarea de prag corespunzătoare;
3) se definesc compușii-țintă, interferențele potențiale și nivelurile maxime tolerabile ale probei-martor;
4) deviația standard în procente a răspunsului sau a concentrației calculate pornind de la răspuns (posibilă numai în intervalul de lucru) a unei determinări triple a unui extract de probă nu trebuie să fie mai mare de 15%;
5) rezultatele necorectate ale probei (probelor) de referință exprimată (exprimate) în BEQ-uri (martor și la nivelul maxim sau la nivelul de acțiune) sînt utilizate pentru evaluarea performanței metodei bioanalitice pe o perioadă de timp constantă;
6) QC pentru probele-martor ale procedurii și fiecare tip de probă de referință se înregistrează și se verifică pentru a se garanta că performanța analitică este în conformitate cu cerințele, în special pentru probele-mator ale procedurii cu privire la diferența minimă impusă la limita inferioară a intervalului de lucru și pentru probele de referință cu privire la reproductibilitatea intralaborator. Probele-martor din cadrul procedurii trebuie să fie atent controlate pentru a evita rezultatele fals conforme atunci cînd se efectuează operațiunea de scădere;
7) rezultatele analizelor realizate prin metodele de confirmare pentru probele suspectate și pentru 2-10% din probele conforme (minimum 20 de probe pentru fiecare matrice) sînt colectate și folosite pentru a evalua performanța metodei de screening și relația dintre BEQ-uri și TEQ-uri. Această bază de date ar putea fi utilizată pentru reevaluarea valorilor de prag aplicabile probelor de rutină pentru matricele validate;
8) buna performanță a metodelor poate fi, de asemenea, demonstrată prin participarea la testările interlaboratoare. Rezultatele probelor analizate în testările interlaboratoare, care acoperă un interval de concentrații care ajunge pînă la, de exemplu, 2x nivelul maxim, pot fi, de asemenea, incluse în evaluarea ratei de rezultate fals conforme, în cazul în care un laborator este în măsură să demonstreze buna sa performanță. Probele acoperă cele mai frecvente modele de congeneri, reprezentînd diverse surse;
9) în timpul incidentelor, valorile de prag pot fi reevaluate, reflectînd matricea specifică și modelele de congeneri doar ale acelui incident individual.
66. Metodele de confirmare a rezultatelor în procesul de raportare presupun următoarele:
1) rezultatele analitice includ nivelurile de congeneri individuali ai PCDD/F-urilor și ai PCB-urilor de tipul dioxinelorși valorile TEQ și se raportează ca estimare inferioară, estimare superioară și estimare mediană, pentru a include o cantitate maximă de informații în raportarea rezultatelor, ceea ce permite o interpretare a rezultatelor în conformitate cu cerințele specifice;
2) raportul include și metoda utilizată pentru extracția PCDD/F-urilor, a PCB-urilor de tipul dioxinelorși a lipidelor. Conținutul de lipide al probei se determină și se raportează pentru probe din produse alimentare cu niveluri maxime exprimate prin raportare la conținutul de grăsimi și cu o concentrație de grăsimi estimată în intervalul 0-2%. Pentru alte probe, determinarea conținutului de lipide este opțională;
3) recuperările etaloanelor interne individuale trebuie să fie disponibile în cazul în care recuperările se situează în afara intervalului menționat la punctul 53 atunci cînd nivelul maxim este depășit (în acest caz recuperările pentru una dintre cele două analize duplicat), iar în celelalte cazuri, la cerere;
4) întrucît, atunci cînd se decide conformitatea unei probe, se ține seama de incertitudinea de măsurare extinsă, și acest parametru trebuie să fie pus la dispoziție. De aceea, rezultatele analitice se raportează ca x ± U, unde x este rezultatul analitic și U este incertitudinea de măsurare extinsă, folosind un factor de acoperire 2, care conferă un nivel de încredere de 95%. În cazul unei determinări separate a PCDD/F-urilor și a PCB-urilor de tipul dioxinelor, suma incertitudinii extinse estimate a rezultatelor analitice separate ale PCDD/F-urilor și ale PCB-urilor de tipul dioxinelor se utilizează pentru suma PCDD/F-urilor și a PCB-urilor de tipul dioxinelor;
5) rezultatele se exprimă în aceleași unități și prin același număr de cifre semnificative ca și nivelurile maxime prevăzute în Hotărîrea Guvernului nr. 520/2010 cu privire la aprobarea Regulamentului sanitar privind contaminanții din produsele alimentare.
67.Metodele bioanalitice de screening în procesul de raportare includ următoarele:
1) rezultatul screeningului se exprimă cu termenii „conform” sau „suspectat a fi neconform”;
2) în plus, se poate da un rezultat indicativ pentru PCDD/F-uri și/sau PCB-uri de tipul dioxinelor exprimat în BEQ, nu în TEQ. Rezultatul probelor cu un răspuns sub limita de raportare se exprimă ca fiind „sub limita de raportare”. Rezultatul probelor cu un răspuns peste intervalul de lucru se raportează ca „depășind intervalul de lucru”, iar nivelul corespunzător extremității superioare a intervalului de lucru se furnizează în BEQ;
3) pentru fiecare tip de matrice a probei, raportul menționează nivelul maxim sau nivelul de acțiune pe care se bazează evaluarea;
4) raportul menționează tipul de test aplicat, principiul de bază al testului și tipul de calibrare;
5) raportul include și metoda utilizată pentru extracția PCDD/F-urilor, a PCB-urilor de tipul dioxinelorși a lipidelor. Conținutul de lipide al probei se determină și se raportează pentru probe din produse alimentare cu niveluri maxime exprimate prin raportare la conținutul de grăsimi și cu o concentrație de grăsimi estimată în intervalul 0-2% (în concordanță cu legislația existentă). Pentru alte probe, determinarea conținutului de lipide este opțională;
6) în cazul probelor suspectate a fi neconforme, raportul trebuie să includă o notă privind măsurile care urmează a fi adoptate. Concentrația de PCDD/F-uri și suma dintre PCDD/F-uri și PCB-uri de tipul dioxinelor din probele cu niveluri ridicate trebuie determinată/confirmată printr-o metodă de confirmare;
7) rezultatele neconforme se raportează numai în urma analizei de confirmare.
68.Metode fizico-chimice de screening în procesul de raportare includ următoarele:
1) rezultatul screeningului se exprimă cu termenii „conform” sau „suspectat a fi neconform”;
2) pentru fiecare tip de matrice a probei, raportul menționează nivelul maxim sau nivelul de acțiune pe care se bazează evaluarea;
3) în plus, nivelurile de congeneri individuali ai PCDD/F-urilor și/sau ai PCB-urilor de tipul dioxinelorși valorile TEQ se pot furniza ca estimare inferioară, estimare superioară și estimare mediană. Rezultatele se exprimă în aceleași unități și prin (cel puțin) același număr de cifre semnificative ca și nivelurile maxime menționate în HotărîreaGuvernului 520/2010 cu privire la aprobarea Regulamentului sanitarprivind contaminanţii din produsele alimentare;
4) recuperările etaloanelor interne individuale trebuie să fie puse la dispoziție în cazul în care recuperările se situează în afara intervalului menționat la punctul 57, iar în celelalte cazuri, la cerere;
6) raportul include și metoda utilizată pentru extracția PCDD/F-urilor, a PCB-urilor de tipul dioxinelorși a lipidelor. Conținutul de lipide al probei se determină și se raportează pentru probe din produse alimentare cu niveluri maxime exprimate prin raportare la conținutul de grăsimi și cu o concentrație de grăsimi estimată în intervalul 0-2% (în concordanță cu legislația existentă). Pentru alte probe, determinarea conținutului de lipide este opțională;
7) în cazul probelor suspectate a fi neconforme, raportul trebuie să includă o notă privind măsurile care urmează a fi adoptate. Concentrația de PCDD/F-uri și suma dintre PCDD/F-uri și PCB-uri de tipul dioxinelor din probele cu niveluri ridicate trebuie determinată/confirmată printr-o metodă de confirmare;
8) neconformitatea poate fi decisă numai în urma analizei de confirmare.
CERINȚELE PIVIND PREGĂTIREA PROBELOR ȘI METODELE
DE ANALIZĂ UTILIZATE ÎN CADRUL CONTROLULUI NIVELURILOR
DE PCB-URI CARE NU SÎNT DE TIPUL DIOXINELOR DIN ANUMITE
PRODUSE ALIMENTARE
Dispozițiile referitoare la pregătirea probelor de la punctele 30-39 se aplică și pentru controlul nivelurilor de PCB-uri care nu sînt de tipul dioxinelor din produsele alimentare.
1) gazcromatografie/detectare prin captură de electroni (în continuare – GC-ECD),
2) gazcromatografie/spectrometrie de masă de joasă rezoluție (în continuare – GC-LRMS),
3)GC-MS/MS,
4) GC-HRMS sau metode echivalente.
71. La identificarea și confirmarea analiților se ia în considerare:
1)timpul de retenție relativ în raport cu etaloanele interne sau cu etaloanele de referință (deviație acceptabilă ± 0,25%);
2)separarea gazcromatografică a PCB-urilor care nu sînt de tipul dioxinelor de substanțele interferente, în special PCB-uricoeluante, mai ales în cazul în care nivelurile probelor sînt în limite legale și neconformitatea trebuie să fie confirmată;
a) monitorizarea cel puțin a următorului număr de ioni moleculari sau de ioni caracteristici din clusterul molecular:
- doi ioni specifici pentru HRMS;
- trei ioni specifici pentru LRMS;
- doi ioni precursori specifici, fiecare cu un ion de tranziție corespunzător produs pentru MS-MS;
b) toleranțele maxime admisibile pentru abundențeleizotopice relative pentru fragmentele de masă selecționate: Deviația relativă a abundenței izotopice relative pentru fragmentele de masă selecționate în raport cu valoarea teoretică a abundenței izotopice sau cu etalonul de calibrare pentru ionul de cuantificare (ionul monitorizat cu cea mai ridicată abundență izotopică) și ionul (ionii) de diagnostic: ± 15%;
4) pentru GC-ECD:
confirmarea rezultatelor care depășesc nivelul maxim cu două coloane de GC cu fază staționară cu o polaritate diferită.
72. Performanța metodei se demonstrează prin validare în intervalul nivelului maxim (de la 0,5 pînă la de 2 ori nivelul maxim), cu un coeficient de variație acceptabil pentru analiza repetată.73. Suma LDC ale PCB-urilor care nu sînt de tipul dioxinelor nu trebuie să fie mai mare de o treime din nivelul maxim.
75. Controlul recuperărilorse face prin:
1) utilizarea de etaloane interne corespunzătoare, cu proprietăți fizico-chimice comparabile cu cele ale analiților de interes;
2) adăugarea de etaloane interne:
a) adăugarea la produse (înaintea procesului de extracție și de curățare);
b) adăugarea posibilă și pentru a extrage grăsimea (înainte de procesul de curățare), în cazul în care nivelul maxim este exprimat prin raportare la conținutul de grăsimi;
3) respectarea cerințelor privind metodele care utilizează toți cei șase congeneri ai PCB-urilor care nu sînt de tipul dioxinelor marcați cu un izotop:
a) corecția rezultatelor pentru recuperările etaloanelor interne;
b) recuperările general acceptabile ale etaloanelor interne marcate cu un izotop sînt între 60% și 120%;
c) sînt acceptabile recuperări inferioare sau superioare pentru congenerii individuali cu o contribuție la suma de PCB-uri care nu sînt de tipul dioxinelor mai mică de 10%;
4) respectarea cerințelor privind metodele care nu utilizează toate cele șase etaloane interne marcate cu un izotop sau alte etaloane interne:
a) controlul recuperării etalonului (etaloanelor) intern(e) pentru fiecare probă;
b) recuperări acceptabile ale etalonului (etaloanelor) intern(e) între 60% și 120%;
5) recuperarea congenerilor nemarcați se verifică prin probe îmbogățite sau probe pentru controlul calității cu concentrații în intervalul nivelului maxim. Recuperările acceptabile pentru acești congeneri sînt între 60% și 120%.
76.În conformitate cu prevederile Legii nr. 50/2013 cu privire la controalele oficiale pentru verificarea conformității cu legislația privind hrana pentru animale și produsele alimentare și cu normele de sănătate și de bunăstare a animalelor laboratoarele trebuie să fie acreditate conform standardului național SM SR EN ISO/IEC 17025:2018 „Cerințe generale pentru competența laboratoarelor de încercări și etalonări”.
77.Indicatorii de performanță pentru suma PCB-urilor care nu sînt de tipul dioxinelor la nivelul maxim sînt indicați în tabelul 7.
Tabelul 7
Indicatorii de performanță pentru suma PCB-urilor
care nu sînt de tipul dioxinelor la nivelul maxim
|
Indicatori
|
Spectrometria de masă prin metoda de diluție a izotopilor |
Alte tehnici
|
|
Fidelitate
|
– 20 pînă la +20% |
– 30 pînă la
+30 %
|
|
Precizie intermediară (RSDR)
|
≤ 15%
|
≤ 20%
|
|
Diferența dintre estimarea superioară și estimarea inferioară a calculului |
≤ 20%
|
≤ 20%
|
1) rezultatele analitice cuprind nivelurile de congeneri individuali ai PCB-urilor care nu sînt de tipul dioxinelorși suma PCB-urilor care nu sînt de tipul dioxinelor, raportate ca estimare inferioară, estimare superioară și estimare mediană, pentru a include o cantitate maximă de informații în raportarea rezultatelor, ceea ce permite o interpretare a rezultatelor în conformitate cu cerințele specifice;
2) raportul include și metoda utilizată pentru extracția PCB-urilor și a lipidelor. Conținutul de lipide al probei se determină și se raportează pentru probe din produse alimentare cu niveluri maxime exprimate prin raportare la conținutul de grăsimi și cu o concentrație de grăsimi estimată în intervalul 0-2% (în concordanță cu legislația existentă). Pentru alte probe, determinarea conținutului de lipide este opțională;
3) recuperările etaloanelor interne individuale trebuie să fie disponibile în cazul în care recuperările se situează în afara intervalului menționat la punctul 75 și în cazul în care nivelul maxim este depășit, iar în celelalte cazuri, la cerere;
4) întrucît, atunci cînd se decide conformitatea unei probe, se ține seama de incertitudinea de măsurare extinsă, și parametrul respectiv trebuie să fie pus la dispoziție. De aceea, rezultatele analitice se raportează ca x ± U, unde x este rezultatul analitic și U este incertitudinea de măsurare extinsă, folosind un factor de acoperire 2, care conferă un nivel de încredere de 95%;
5) rezultatele se exprimă în aceleași unități și prin același număr de cifre semnificative ca și nivelurile maxime prevăzute în HotărîreaGuvernului nr. 520/2010 cu privire la aprobarea Regulamentului sanitar privind contaminanții din produsele alimentare.